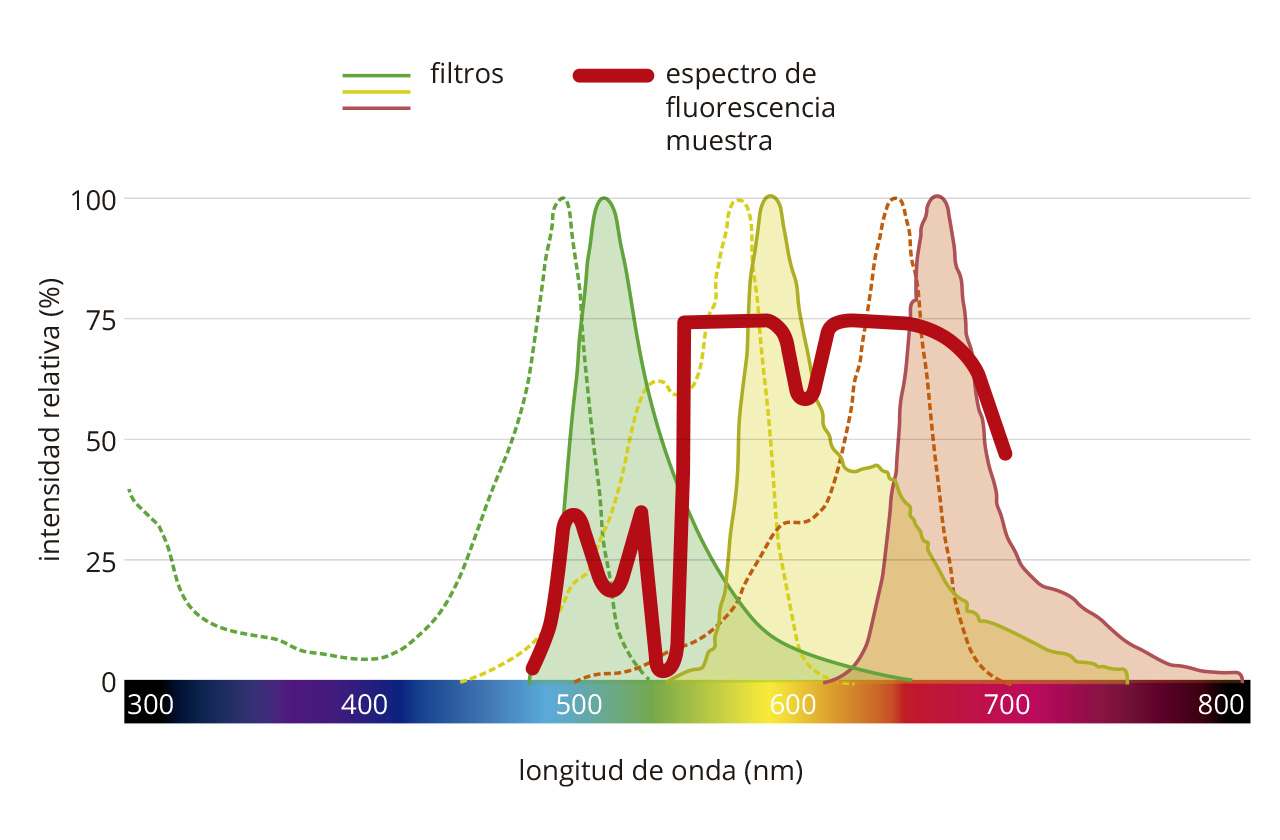
Olympus modelo FV1000, secuencial espectral.
El equipo cuenta con cuatro láseres de diodo (L405nm, L473nm, L559nm, L635nm), cuatro canales y dos detectores con platina motorizada (foto cortesía del Dr. Armando Castillo, Centro Neurociencias INDICASAT, Laboratorio de Microscopía Electrónica y Confocal del Instituto Smithsonian de Investigaciones Tropicales, en Panamá).