Fluorócromos
Los fluorócromos son moléculas capaces de producir fluorescencia cuando absorben radiación de longitud de onda específica. En algunos casos suelen ser proteínas, con péptidos inestables o fluoróforos. Estos son responsables de la respuesta de la proteína a la absorción de energía y emisión de fluorescencia. Son moléculas heterocíclicas polinucleares que contienen nitrógeno, azufre y, u oxígeno, con sistemas de electrones deslocalizados que les permiten unirse a una especie biológica.
Fluoróforo
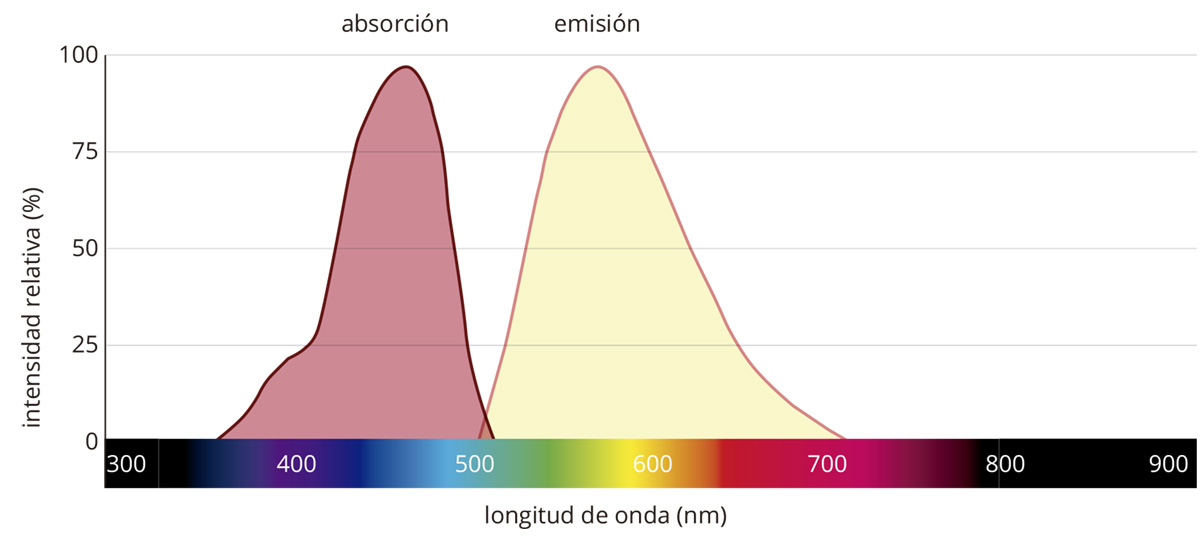
Es el dominio estructural o región específica del fluorócromo que es capaz de exhibir fluorescencia (Olympus, 2012). El electrón del orbital más externo en la molécula, determina su eficiencia como compuesto fluorescente y la longitud de onda de la absorción y la emisión. Cuando un compuesto fluorescente, en su estado fundamental, absorbe energía de la luz, pueden ocurrir alteraciones en los estados electrónicos, vibracionales y rotacionales de las moléculas. Esta energía a veces mueve un electrón a un orbital que está, en promedio, más alejado del núcleo. Esta transición, y la excitación, ocurren muy rápidamente (en fentosegundos). Por lo general, el estado de excitación también pone en movimiento vibraciones moleculares en las que las distancias internucleares varían con el tiempo, de manera que toda esta energía absorbida se elimina finalmente. La relajación vibratoria y la emisión de fluorescencia son las principales formas en que el fluoróforo regresa a su estado fundamental de baja energía (Lichtman & Conchello, 2006).
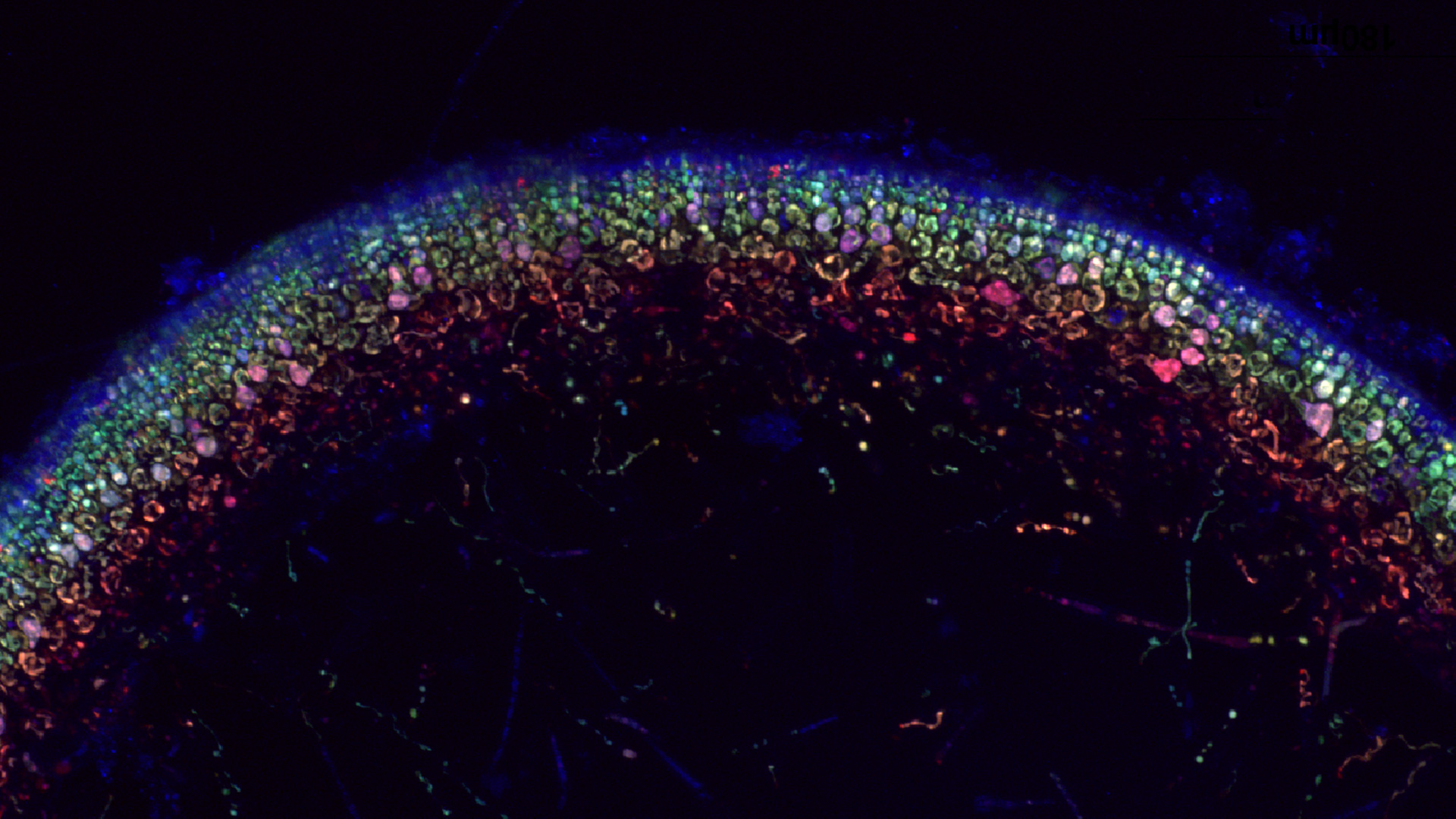
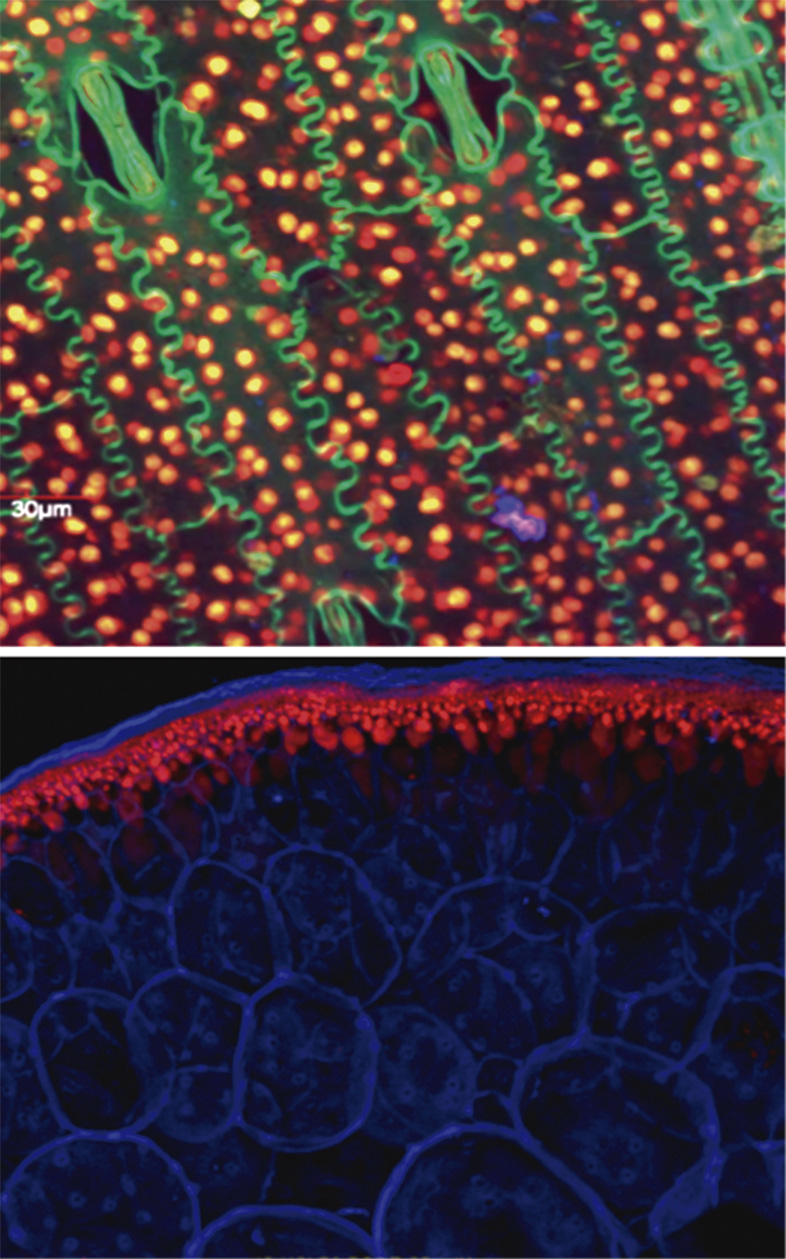
Un buen ejemplo de esto son las proteínas verdes fluorescentes (GFP)―FFig. 5, Modelo tridimensional de la proteína verde fluorescente (GFP)―. La GFP es un polipéptido bioluminiscente que consiste en 238 residuos aislados del cuerpo de la medusa Aequorea victoria. La GFP convierte la quimio luminiscente azul de la aequorina en las medusas, en luz verde fluorescente. No está claro por qué estas medusas usan la fluorescencia, por qué el verde es mejor que el azul, o por qué producen una proteína separada para la fluorescencia verde en lugar de simplemente mutar la aequorina presente para cambiar su longitud de onda; pero, en el laboratorio, la GFP puede ser incorporada a una variedad de sistemas biológicos para funcionar como una proteína marcadora.
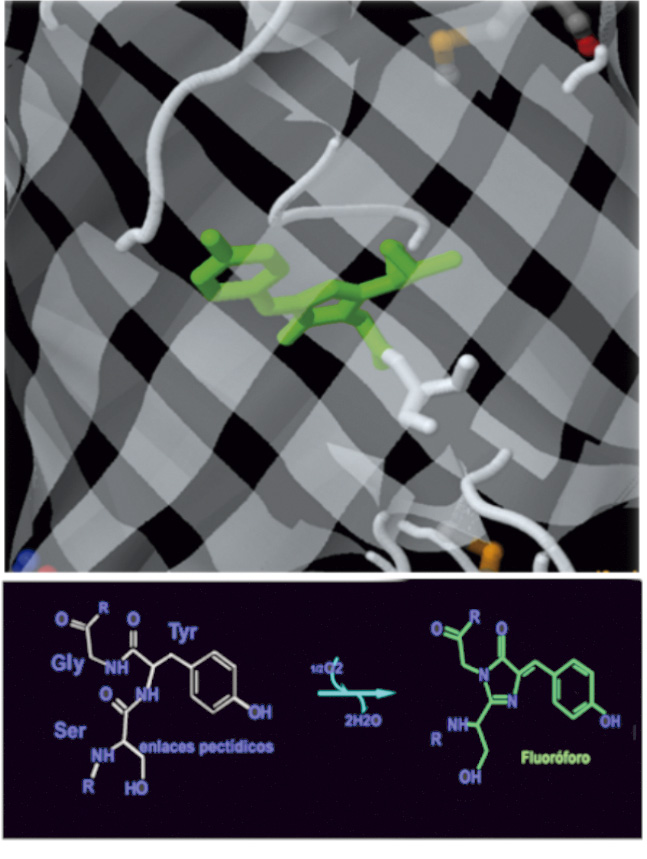
Desde su descubrimiento en 1962, la GFP ha desempeñado un papel importante en la investigación como una herramienta para monitorear la expresión de genes, la localización celular, la movilidad de proteínas, el tráfico intracelular y las interacciones entre varias proteínas de membrana y citoplásmicas, así como muchas otras. La ubicación del cromóforo (Fig. 6) consistente de un péptido o cromófobo resultante de la ciclación espontánea y la oxidación de la secuencia -Ser65 (o Thr65) -Tyr66-Gly67-, requiere el pliegue de la proteína nativa tanto para la formación como para la emisión de fluorescencia (Hodis et al. 2013).
Dentro del sistema de barril de la proteína verde fluorescente (GFP). Vista inferior: el fluoróforo está formado por tres residuos amino (Ser65Tyr66Gly67) de (Hodis et al. 2013).